实体瘤的缺氧微环境对临床肿瘤学中的铁素体和免疫疗法构成了技术瓶颈。基于肿瘤细胞特殊生理信号的纳米反应器能够通过缓解细胞内的缺氧环境来避免各种肿瘤耐受机制。
2023年3月2日重庆大学蔡开勇教授团队在ACS Nano(IF=18)在线发表题为 “Oxygen Self-Generating Nanoreactor Mediated Ferroptosis Activation and Immunotherapy in Triple-Negative Breast Cancer” 的论文,该研究报道了氧自生纳米反应器,用于介导三阴性乳腺癌的铁死亡激活和免疫治疗。

由于血管异常和血液供应不足,肿瘤细胞内部存在永久或暂时的缺氧区域。缺氧与肿瘤细胞的侵袭、转移和耐药性密切相关。此外,缺氧影响肿瘤微环境中免疫细胞的活性,导致免疫抑制肿瘤微环境(TIME)加速肿瘤生长。缺氧微环境中的肿瘤细胞可以分泌含有miR301a的外泌体,其倾向于通过激活PTEN/PI3Kγ信号通路促进肿瘤相关巨噬细胞(TAMs)表型向肿瘤促进M2表型的转变。重新极化为M1表型的TAMs可以增加浸润CD8+T细胞分泌的IFN γ细胞因子的含量,这将下调肿瘤细胞表面胱氨酸转运体的表达,从而增强肿瘤细胞的脂质过氧化和铁死亡。此外,活化的HIF-1α蛋白通过增加脂肪酸摄取和脂质储存,帮助缺氧肿瘤细胞对抗铁死亡,从而最小化过氧化介导的内膜损伤。因此,克服肿瘤细胞缺氧可能是同时将TAMs表型重新极化为M1表型并诱导铁死亡的治疗策略。由于特殊的新陈代谢,肿瘤细胞中积累了大量的过氧化氢(H2O2)和还原型谷胱甘肽(GSH)。随着纳米技术的快速发展,各种纳米反应器被开发出来,通过与细胞内H2O2含量反应生成O2。纯与H2O2或GSH反应的纳米反应器已被大量报道。开发一种能与H2O2和GSH反应的纳米反应器可能成为缓解肿瘤缺氧微环境,进而激活肿瘤免疫反应和铁死亡的潜在策略。
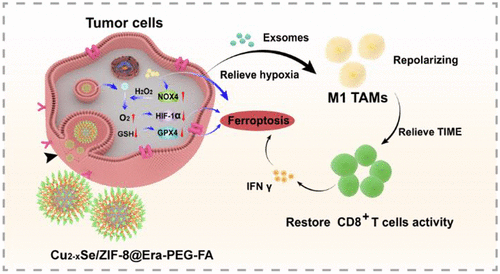
文章模式图(图源自ACS Nano)
基于初步研究的见解,研究者报道了一种纳米反应器Cu2−xSe,它消耗细胞内GSH并生成O2,利用Cu+与H2O2反应生成O2和Cu2+,而Cu2+与GSH反应生成Cu+和GSSG。为了增强纳米反应器诱导的脱铁能力,研究者对ZIF-8涂层进行了改性作为Cu2−xSe的外层,并加载了脱铁活化剂Erastin。此外,为了延长纳米反应器的血液循环时间和肿瘤特异性,在纳米反应器表面修饰了PEG聚合物和FA分子(Cu2−xSe/ZIF-8@Era-PEG-FA)。肿瘤细胞特异性摄取后,Cu2−xSe/ZIF-8@Era-PEG-FA从以下方面诱导铁死亡。首先,酸触发释放了Erastin诱导的结合和抑制电压依赖性阴离子通道的铁死亡。然后,纳米反应器中Cu2+对细胞内GSH含量的消耗可以下调GPX4蛋白的表达,从而增加细胞内脂质ROS并诱导铁死亡的发生。此外,Erastin负载的纳米反应器可以上调NOX4蛋白的表达,并增加细胞内H2O2的含量,以便在纳米反应器中与Cu+反应形成O2。随着O2的产生,肿瘤细胞中的缺氧微环境得到缓解,依赖于HIF-1α表达的铁死亡拮抗作用减弱,肿瘤细胞分泌的外泌体中miR301-a基因的表达减少,从而使TAMs的表型重新极化为M1,并增加CD8+T细胞分泌的IFNγ含量。研究者假设,多功能自供电纳米反应器可以通过铁死亡和免疫疗法的联合作用杀死肿瘤细胞并抑制肿瘤生长,这可能为肿瘤适应症的临床干预提供了途径。
参考消息:https://pubs.acs.org/doi/abs/10.1021/acsnano.2c10893